内容提要
本文通过阐述相关高危型人乳头状瘤病毒(hr-HPV)宫颈感染与宫颈癌发生的科学问题研究现状,以及中国宫颈癌“三阶梯”筛查的困境,展开评述第一阶梯宫颈液基薄层细胞学检测(TCT)筛查,以及在人口大国难以施展覆盖面达全女性人口的80%,以及现阶段hr-HPV检测在“三阶梯”筛查模式中的角色问题,指出适龄人群接种宫颈癌预防性疫苗(即HPV疫苗)后也不能终止宫颈癌的筛查值得关注问题,推介WHO倡导的新技术发展可以更全面地预防和控制宫颈癌及其观点,提出了推进hr-HPV宫颈感染“男女性伴同防同治”是弥补宫颈癌防治重要环节的专家观点,最后介绍了符合中国国情的宫颈癌“三阶段分层筛查”的自主创新解决方案。
关键词:宫颈癌筛查,宫颈病变,hr-HPV,三阶梯筛查,HPV疫苗,清除hr-HPV,男女性伴,同防同治,三阶段分层筛查
作者:罗新
单位:暨南大学附属第一医院妇科,广州,广东,510630
引言
中国是人口大国,“十三五”规划收官之际刚刚传来消除极度贫困的喜讯,但解决人口相对贫困的问题还任重道远。据悉到2030年预测我国人口仍在13.73亿。按约占人口50%来算,大约有6.5亿为女性人口。依宫颈癌筛查的适龄女性人口70%计算,每年约有4.5亿的女性需要接受宫颈的防癌筛查。若每年筛查1.0亿女性,则需要4.5年才能完成一轮筛查,若每年筛查4500万女性人口,需要45年才能在全区域内完成全适龄女性人群的筛查。
现阶段中央到地方两级财政支持的全国及省市地县乡的区域性筛查规模,近十余年来累计覆盖规模仅为正常适龄女性人群的10%~20%,筛查规模难以覆盖全区域全正常适龄人群。而且各地区因经济水平参差不齐,决定筛查的间隔频率不同,有1次/年、1次/2年或1次/3年不等。而且有动员参加筛查人群相对稳定的趋势,新增规模覆盖的人群有限。近年来倡导用HPV检测手段在正常适龄女性人群中实行首筛,本意是弥补TCT筛查的困境和缺憾,但事实上该方案只是检测了正常人群感染hr-HPV状态或称易感人群,未能筛查出子宫颈的病态。
单纯1次HPV检测阳性也不代表持续性感染!也不是诊断宫颈病变的治疗标准!况且hr-HPV检测阳性致患者恐慌,医务人员自己感染hr-HPV也会有不同程度的畏惧心理。实际上造成过度诊治50%~90%感染hr-HPV女性的宫颈病变!医务人员在处置hr-HPV宫颈感染者时,也对约90%感染hr-HPV者能在24个月内自动清除持有疑虑,导致过度处置!
一、hr-HPV宫颈感染与宫颈癌发生的科学问题明朗共识
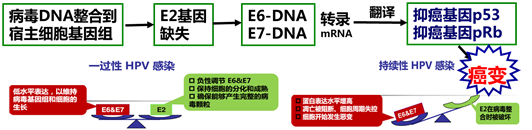
近90%的鳞状上皮内病变(SIL)和99%的宫颈癌组织中发现高危型HPV感染,其中70%与HPV16、HPV18相关。高危型HPV产生病毒癌蛋白,其中E6和E7作用于宿主细胞的抑癌基因p53、pRb,使之失活降解,继而通过一系列分子事件导致癌变[1],如下图所示。hr-HPV宫颈感染是宫颈癌发生的“元凶”。接种HPV预防性疫苗可实现宫颈癌的一级预防[1]。
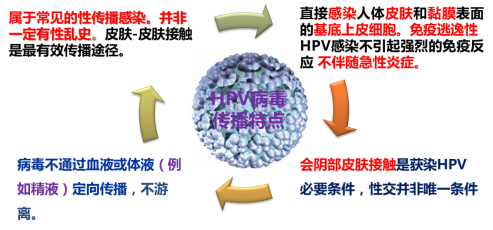
男女性交不是hr-HPV宫颈感染的唯一方式,HPV不通过血液、体液或精液传播,会阴部皮肤接触是hr-HPV感染必要且最有效的性传播条件[2],如下图所示。HPV病毒感染的特点:①至今HPV只发现在人体上皮组织传播,其感染形式不伴有炎症表现,肉眼往往无法观察是否HPV感染;②HPV不能/不易体外培养和做体内动物实验模型;③HPV不进入血液循环系统或体液;④全身系统用药不是最佳的治疗方式;⑤在人的皮肤及上皮细胞基底层复制、表达,要求药物必须具备良好的透皮吸收性能才可能发挥作用。
相对宫颈癌和高级别病变的发病而言,其特点是HPV感染的高发生率,宫颈高级别病变的低患病率。一项简单的临床模型设计,基于美国人群一生中的性伴侣数量和每一对伴侣感染HPV的概率,评估在未接种HPV疫苗的情况下美国人一生中感染HPV的概率。研究显示,美国人群中有性行为的男性和女性一生感染HPV几率高达85%~90%,大多数感染可以被自身清除[3],小部分患者hr-HPV持续感染,可导致病变并最终进展为宫颈癌[4]。
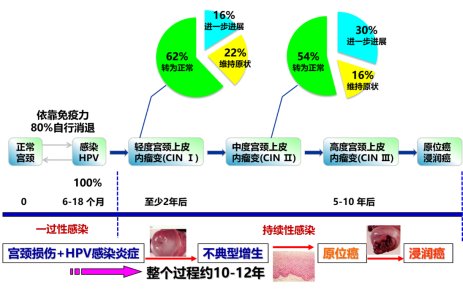
绝大部分的hr-HPV宫颈感染者依赖自身的免疫功能可以自动清除感染的hr-HPV,尤其是<30岁的女性。因此,国际公认的宫颈癌筛查策略是,<30岁的女性以TCT筛查结果为主,≥30岁的女性则应该接受TCT和HPV双筛。在宫颈炎至宫颈病变的发展过程中,相当一部分病变会逐渐退回到正常范围或“原地踏步”保持癌前病变级别不变,这取决于宫颈感染hr-HPV女性的自身免疫机能高低,如下图所示。但值得注意的是,一旦进入宫颈上皮内瘤变III级(CIN3)及以上的病变,就不能退回到正常或低级别病变,故应积极干预治疗。
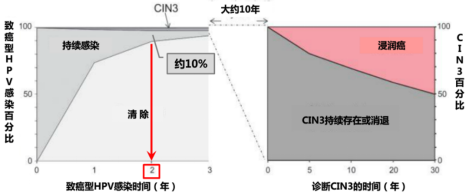
总体来讲,正常人群HPV自动清除率可高达90%,仅仅10%的女性会持续性感染,大约10年以后,至30年可能有50%的hr-HPV宫颈持续感染者罹患≥CIN3病变,另有50%的CIN3病变持续存在或渐渐消退,如图下所示。
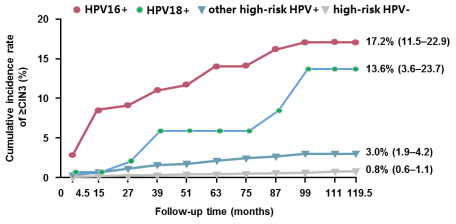
如果是hr-HPV16型或hr-HPV18型宫颈感染,处理起来就应该更积极一些,因为它们较其他型别的hr-HPV宫颈感染,在同样的时间内发生高级别病变的比例更高。即持续存在10年后,≥CIN3的病变分别为17.2%(11.5%~22.9%)和13.6%(3.6%~23.7%),故处理起来应更加积极些,尤其是已经完成生育计划者。
二、hr-HPV检测在“三阶梯”筛查模式中的角色和尴尬局面
我国在hr-HPV宫颈感染与宫颈癌防控的模式中,采用hr-HPV检测到底是作为全区域内全正常人群的初筛措施,还是作为“三阶梯”筛查模式的分流手段,当前制订的宫颈癌筛查专家共识或指南,是否可以定义为医疗机构对区域内适龄女性,寻求宫颈病变和宫颈癌发生早诊早治的机会性分流排查方案。由于hr-HPV检测和“三阶梯”筛查都未能理想地解决全区域内全适龄人群的普查普筛问题,令广大临床医生陷入困境,感到无奈。
借鉴国际上认同的“三阶梯”筛查模式,不适合在幅员辽阔的人口大国进行全区域内全正常适龄人群一个不少、一个不漏、一个不掉的筛查国情,原因如下。
①每轮筛查人数应达4.5亿。地区间经济发展和医疗资源配置水平参差不齐,差异巨大。筛查普及教育,难以大面积推广达到预期结果,百姓难有较好的获得感!
②“三阶梯”筛查方案的推广应用与区域内医疗资源和正常适龄人群需求不相匹配。病理专业注册医师不足1万人,加上病理技师也仅3万人左右。专门从事细胞病理学诊断的医师奇缺,分子生物学和细胞生物学替代筛查方法昂贵,方法需专人专项操作,培养学习时长。
③每轮新增筛查人群比例低,可疑阳性人群因常因经济拮据,复诊随访脱失率高。
④中心城市医疗机构支援偏远地区的筛查方法效果不佳。靠中心城市的医疗机构深入支援基层乡镇卫生医疗机构或偏远城市社区卫生医疗机构的方法,人力资源不足,资金支持难以为济,实施全区域正常适龄人群的全覆盖筛查有困难。
⑤大型医疗机构、学术团体、社会“慈善”组织、民营医院联合企业产品以及第三方检测机构组织实施或提出新的多元化筛查方案,实际上是无序化,甚至是多元恶化。
⑥拟以HPV检测手段替代三阶梯在正常适龄人群中推行的初筛,hr-HPV检测阳性既会引起患者恐慌,也使医务人员自身心理畏惧。而且阳性检测结果仅表示易感人群hr-HPV感染的状态,不代表宫颈病变级别。
因此,笔者认为“目前推荐的筛查指南只是适合在有条件的医疗机构,实际上是推行区域内正常适龄人群的机会性排查,以hr-HPV检测作为分流,不是真正意义上的普查普筛。”
三、适龄人群接种宫颈癌预防性疫苗仍需接受宫颈癌筛查
即使接种了宫颈癌预防性疫苗(HPV疫苗)的所有适龄女性,也不应终止宫颈癌的筛查,这个问题值得关注。2002年至2017年世界卫生组织(WHO)发布了一系列宫颈癌防控相关文件,如2002年和2006年的《发展中国家的宫颈癌筛查》[5,6],2011年《引入HPV疫苗的准备:政策与方案指南》[7]和《WHO指南:使用冷冻法国家治疗宫颈上皮内瘤变》[8],2013年《WHO为预防宫颈癌的筛查和治疗癌前病变的指南》[9],2014年《宫颈癌综合防治基本实践指南(第二版)》[10],以及2014年和2017年《HPV疫苗WHO立场文件》[11,12]。
这些文件倡导为女性健康投入更多的关注和资源,不仅致力于解决孕产妇保健和计划生育问题,同时积极参与卫生系统建设,通过不断研发、测试和实施新的技术,使宫颈癌护理在低收入和中等收入国家变得可行和可负担。新技术的发展可以更全面地预防和控制宫颈癌,并为全球女性建立更健康的未来[9]。WHO的文件谈接种宫颈癌疫苗的群体免疫立场的内容较多,而涉及清除宫颈感染hr-HPV的建议及共识较少。
首支HPV疫苗2006年在全球上市,之后陆陆续续上市的HPV疫苗产品共有三种,分别是二价疫苗、四价疫苗、九价疫苗。自上市以来最早应用的HPV疫苗至今已经14年了。
我国在2016年、2017年和2018年批准上市了进口的二价疫苗、四价疫苗、九价疫苗,自主研发的国产二价疫苗于2019年上市,实际上现在已有4种HPV疫苗应用于中国适龄女性群体。
二价疫苗产生的抗体可以对抗中和hr-HPV16和hr-HPV18,其预防宫颈高级别病变和宫颈癌发生的效力可达70%。二价疫苗有进口疫苗和国产疫苗两种提供给适龄女性。国产(二价)疫苗有一个特点,对于9~14岁的女性可以接种两剂,达到与三剂一样的效果。
四价疫苗产生的抗体可以中和对抗两种lr-HPV6和lr-HPV11,预防两种低危型HPV感染所致的生殖器尖锐湿疣,这两种低危型HPV的感染实际上与90%的尖锐湿疣相关;另外仍可中和对抗hr-HPV16和hr-HPV18两种高危型HPV感染所致的宫颈病变。在我国临床试验中由于尖锐湿疣的病例很少,不足以获得其对生殖道尖锐湿疣有预防效果的相关大数据。但它与二价疫苗一样,对hr-HPV16和hr-HPV18感染导致高级别宫颈病变和宫颈癌,同样可以达到70%以上的预防效果。
九价疫苗是包含HPV6/11/16/18/31/33/45/52/58这九种型别的减毒活疫苗, 2018年在我国获得有条件上市许可,当时在国内并没有III期的临床数据,是根据四价疫苗在中国的临床试验以及在东南亚地区,包括中国香港和台湾地区的黄种人接种临床试验批准上市应用的。现正在进行九价HPV疫苗的III期临床试验。根据这些数据批准其可用于16~26岁的女性,可预防90%以上的高级别宫颈病变和宫颈癌。
值得关注的是,不论哪种疫苗都包含了hr-HPV16和hr-HPV18这两种高危型HPV感染预防,价数多的还包括了常见的hr-HPV31型、hr-HPV33型、hr-HPV45型、hr-HPV52型和hr-HPV58型,接种后所产生的抗体间有交叉的免疫防护作用。对适龄女性接种HPV疫苗虽均可从中获益,但不容忽视的是,不论接种了HPV疫苗与否,仍需接受例行的宫颈癌筛查。因为这类疫苗是根据HPV壳的晚期基因L1和L2研发的,不含HPV核基因的预防性疫苗。由于HPV不能体外培养,目前也没有成功的动物模型实验结果,更没有杀灭HPV的药物试验结果,所以,对于宫颈感染HPV的女性,帮助其清除生殖道内的HPV是宫颈癌防治的重要环节。直到出现根据HPV核的早期基因E6和E7等研制出治疗性HPV疫苗,才算取得宫颈癌防治的重大进展。
未完待续……
参考文献
[1] 林仲秋,第25章子宫颈肿瘤,第1节子宫颈鳞状上皮内病变.《妇产科学》国家卫生健康委员会“十三五”规划教材,全国高等院校教材教材,主编:谢幸,孔北华,段涛. 人民卫生出版社、2018年7月第9版,第1次印刷.p295-297.
[2] 彭雪,胡丽娜. HPV感染及危险因素的研究[J].实用妇产科杂志2010,26(3):168.
[3] Chesson H W, et al. Sexually Transmitted Diseases, 2014, 41(11): 660.
[4] J Natl Cancer Inst 2008;100(7): 513–7.
[5] WHO. Cervical Cancer Screening in Developing Countries. 2002
[6] WHO. Comprehensive Cervical Cancer Control A Guide toEssential Practice. 2006.
[7] WHO. Preparing for the introduction of HPV vaccines: policy and programme guidance for countries. 2011.
[8] WHO. Use of cryotherapy for cervical intraepithelial neoplasia. 2011
[9] WHO. WHO guidelines for screening and treatment of precancerous lesionsfor cervical cancer prevention. 2013.
[10] WHO Library Cataloguing-in-Publication Data Comprehensive cervicalcancer control: a guide to essential practice – 2nd ed. 2014:1-364.
[11] World Health Organization. Human papillomavirus vaccines: WHO position paper May 2014. Wkly Epidemiol Rec. 2014, 85, 465–492.
[12] World Health Organization. Human papillomavirus vaccines: WHO position paper May 2017. Wkly Epidemiol Rec. 2017, 92, 241–268.
专家介绍

罗新 教授
第九任暨南大学附属第一医院妇产科主任、教研室主任、妇科主任;第十任妇科主任;第十一任妇科主任、妇产科副主任。曾任第六代武汉大学人民医院妇产科主任、妇科主任,武汉大学第一临床学院妇产科教研室主任,第四任武汉大学医学院妇科研究室主任。
国际及全国性学术团体兼职:
International Urogenencological Associasion, IUGA Member,国际妇科泌尿学会会员、中国地区培训师;International Continence Society, ICS Member,国际尿控学会会员/世中联第一、二届盆底医学专业委员会副会长;International Society of Pelvic Floor Disorders,国际盆底疾病协会理事会常务理事;俄罗斯西南国立大学医疗管理专业教授,博士生导师。
中华妇产科学会盆底学组全国委员/感染性疾病协作组成员;中华预防医学会微生态分会妇产科学组委员;中华预防医学会妇女保健分会更年期保健学组全国委员/妇女盆底功能障碍防治国家级专家;中国医师协会全国基层生殖道感染防治培训项目国家级培训师。
中国科学院优生科学协会中国宫颈癌与阴道镜专业委员会(CSCCP)常务委员;中国医疗保健国际交流促进会第一、二届妇产科专业委员会常务委员创新技术与临床应用学组组长 妇科盆底修复与微整形学组副组长;中国康复医学会产后康复专业委员会常务委员/盆底康复学组副主任委员;中国妇幼健康研究会宫颈癌防控专业委员会常务委员;中国抗癌协会肿瘤光动力治疗专业委员会全国委员;中国整形美容协会第一、二届女性生殖整复分会常务理事/科技创新与器官整复分会阴道整复与紧致专委会主任委员;中国抗癌协会肿瘤光动力治疗专业委员会委员;中国性学会第四届性医学专业委员会副主任委员。
国家卫健委“生殖道感染诊疗技术专项能力培训项目”;“生殖健康诊疗服务能力提升专项”国家级讲师/ 妇科内镜微创技术推广考核专家。
“中国宫颈癌防治工程项目”组委会成员、中国宫颈癌防治工程特聘专家。
省市级重要学术团体兼职
湖北省医学会第三届青年委员第四届常务委员、第五届妇产科分会副主任委员;武汉医学会第一届腔镜外科学会副主任委员;北京健康促进会宫颈病变与宫颈癌防治专家委员会副主任委员;北京市红十字基金会“同心共铸中国心”妇产科专家委员会广东省(市)分会副主任委员。广东省医师协会第一届妇产科医师分会常务委员、第二届副主任委员;广东省抗癌协会妇科肿瘤专业委员会委员;广东省医师协会医师规范化培训指导小组专家;广东省医学会妇产科学会盆底学组副组长;广东省泌尿生殖协会第一、二届常务理事/第一、二届盆底学分会主任委员;广东省优生优育协会第四届、第五届、第六届生殖调节专业委员会副主任委员;广东省整形美容协会第一届女性生殖整复分会常务委员、第二届女性生殖整复分会名誉主任委员。
妇产科学专业杂志兼职
《中国实用妇科与产科杂志》、《实用妇产科杂志》、《中国妇产科临床杂志》、《中国骨质疏松杂志》常务编委;《国际妇产科学》杂志、《国际妇科肿瘤杂志(中国版)》和《中华腔镜外科杂志》(电子版)编委;《中华妇产科杂志》、《武汉大学学报(医学版)》审稿专家;《中国计划生育和妇产科杂志》副总编。
专著、论文及主要科研成果
主编译、副主编译或参编译专著41部(篇章节)。发表论文286篇,第1作者或通讯作者论著139篇;SCI和ISTP收录英文论文54篇和8篇。横向科研基金13项,部省厅级纵向科研基金7项。主持广东省科技厅科研基金项目1项;广东省教育厅151工程项目1项;卫生部科技项目1项;国家自然基金面上项目1项“十一五”“十二五”“十三五”重点研发计划重点专项子项目各1项;浙江省重大科技项目子项目1项。国家卫健委科研所专项课题1项。广东省科技厅产学研项目1项并列主持人。科技部国家自然基金面上项目、地区合作项目和青年基金初评专家;重点项目初评及二审会评专家.华夏医学科技二等奖,解放军医疗科技成果二、三等奖,中国美容整形协会科学技术奖创新奖各1项。中国宫颈癌防治工程“生命之托,华夏同行”2018最美宫颈守护者“专业精英奖”。中国宫颈癌防治工程“生命之托,华夏同行”2019全国公益巡讲“传道受业奖”。培养博士后1位,博士生19位,硕士生56位。




