作者:耿宇宁(首都医科大学附属北京妇产医院妇瘤科)
审校:吴玉梅(首都医科大学附属北京妇产医院妇瘤科)
卵巢癌在中国女性癌症发病中排名第十位,在妇科恶性肿瘤中发病位居第三,死亡率位居第一。2020年我国卵巢癌新发病例55342例,死亡37519例[1]。75%以上的卵巢癌患者在诊断时已处于晚期(FIGOIII期或IV期),其5年生存率低于25%[2],严重危害女性健康。
晚期上皮性卵巢癌患者的主要治疗模式包括初始肿瘤细胞减灭术(PDS)+术后辅助化疗,以及新辅助化疗(NACT)联合间歇性肿瘤细胞减灭术(IDS)两种。两种治疗模式的选择方面存在争议。手术切除所有肉眼可见病灶(R0)已被证明是晚期卵巢癌最重要的独立预后因素[3-6]。据报道,R0切除率每上升10%,患者总生存率(OS)上升5.5%[3]。若达到R0切除效果,通常手术范围较大,围术期并发症发生率较高。对于不能达到R0切除且肿瘤负荷相对高的患者,NACT联合IDS可提高R0的切除率,减少围术期并发症,成为PDS的替代方式。但滥用NACT可能造成一部分患者延误手术时机,影响预后。
回顾性研究发现,NACT-IDS患者的生存结局并不逊于PDS人群,且围术期发病率及死亡率较低。基于这项回顾性研究的结论,至少有6项III期前瞻性随机对照试验(RCT)来评价NACT的治疗效果,其中最早的一项研究是欧洲癌症研究和治疗组织(EORTC)发起的EORTC 55971试验,于2010年发表在《新英格兰医学杂志》[7]。英国医学研究委员会临床试验中心(MRC-CTU)发起的CHORUS(Chemotherapy or Upfront Surgery)研究,其试验设计与EORTC55971相似,其结果于2015年发表在《柳叶刀》杂志上[8]。
日本临床肿瘤治疗组JCOG0602研究[9]的特点是,在论证影像学联合肿瘤标志物可以替代腹腔镜技术用于术前诊断可行性的基础上,以影像学检查作为术前评估,对晚期卵巢癌患者的治疗选择进行RCT。SCORPION研究[10]是以腹腔镜术前评估为基础,活检组织病理学检查作为诊断基础,针对高负荷卵巢上皮性癌患者,比较NACT-IDS与PDS的生存结局,其试验为优效性设计。另外两项研究,一项是德国发起的多中心研究,即TRUST(Trial on Radical Upfront Surgery in the Advanced Ovarian Cancer)研究[11]已经完成入组;中国发起的亚洲多中心临床研究SUNNY(Study of Upfront Surgery Versus Neoadjuvant Chemotherapy in Patients with Advanced Ovarian cancer)[12]正在招募患者中。
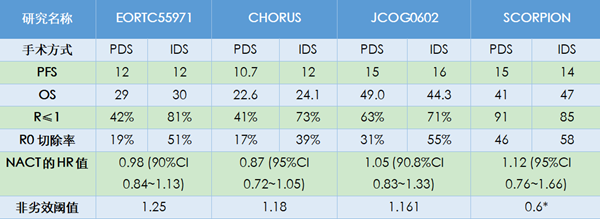
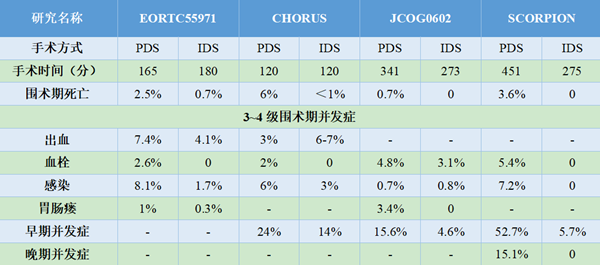
已发表研究结果的四项临床试验中,EORTC55971和SCORPION研究入组患者均为IIIC期和IV期患者,CHORUS和JCOG0602研究还纳入了少量IIIB期患者。SCORPION研究为单中心优效性设计,其他三项为多中心非劣效性设计。四项研究的设计及入组人群特点如表1所示。

上述4项临床研究患者的生存结局显示,PDS组无进展生存期(PFS)在10.7~15个月,总生存期(OS)在22.6~49个月,NACT-IDS组PFS在12~16个月,OS在24.1~47个月(表2)。结论是NACT-IDS与PDS组的PFS和OS无显著性差异。JCOG0602和SCORPION两项研究中PFS与OS较高,可能与其R0切除率相对较高有关。
SCORPION研究是单中心试验,最大限度地达到R0切除,避免了多中心手术操作方面的异质性。该研究入组的均为高肿瘤负荷(PIV评分8~12分)患者,PDS组平均手术时间451分钟,手术难度大,切除范围广。尽管肿瘤负荷较高,但R0切除仍会使患者获益,同时该研究使用贝伐珠单抗改善患者生存结局。
*优效性设计
从生存结局上看,NACT-IDS对晚期卵巢癌患者的治疗效果并不逊于PDS。EORTC55971和CHORUS研究的入组人群相似,将两项试验的数据合并分析发现,对于FIGO IV期患者,NACT与更好的PFS和OS相关,而骨盆外转移小于5 cm的FIGO III期患者经PDS治疗后有更好的PFS。IV期和盆腔外转移超过5 cm的患者考虑NACT[13]。无论采用哪种治疗方式,R0切除仍是手术治疗的目标。
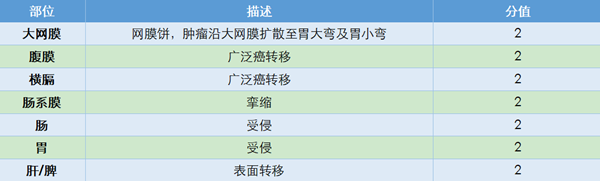
对手术达到R0切除可能性的评估研究也在不断发展。2006年Fagotti等建立了以腹腔镜探查结果为基础的晚期卵巢癌患者手术完整切除可能性的预测评分系统。研究将7个肿瘤发生部位进行赋值,累加计算预测值(PIV)(表3),提出预测手术完整切除的可能性。结果发现PIV≥8分时,100%患者不能完成满意减瘤术[14]。
2013年Fagotti等又进行了多中心研究验证腹腔镜评估的准确性,并对腹腔镜评分进一步详细描述(表4)。研究发现,腹腔镜除了对肠系膜挛缩的评价能力较差以外,对其他部位肿瘤侵犯的评价能力均较高[15]。
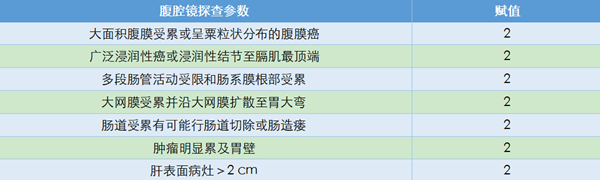
腹腔镜评分系统的优势在于可以明确腹腔内病灶部位、肿瘤负荷并同时进行活检明确肿瘤性质,但也存在一定的局限性,如手术操作受腹腔粘连影响,无法评估腹腔外的病灶等。腹腔镜评分对肿瘤治疗预后是否有影响,目前尚没有明确报道。
2017年,Suidan等[16]在既往研究的基础上,用多因素分析的方法,根据影响因素与术后残留风险优势比进行风险因素赋值,建立以CT结果为基础的预测手术残留的评分系统(表5)。在总分0~2分的患者中,45%在PDS时会有病灶残留;在总分为3~5分和6~8分的患者中,这一比例分别上升到68%和87%;总分在9分以上的患者发生率最高为96%。
随着妇科肿瘤手术治疗技术的进步,出现了更加广泛的切除上腹部及盆腔病灶达到满意肿瘤细胞减灭的术式,即卵巢肿瘤超根治术(Ultra-radical surgery)。2011年一项回顾性研究[17]将超根治术定义为全腹子宫切除术+双侧输卵管卵巢切除术+大网膜切除术+(腹主动脉旁/盆腔/闭孔)肿大淋巴结切除以及以下一种或多种术式,包括上腹部手术(脾切除术/横膈膜或腹膜剥脱术/肝切除术)、肠道切除术或造瘘术,以及尿路手术。
SCORPION研究[15]发现,对高肿瘤负荷的患者行初始肿瘤细胞减灭术达到R0,98.8%的患者需要进行上腹部手术,手术范围包括膈肌病灶切除术(64.6%)、胸腔引流(6.3%)、胰腺尾部切除术(3.3%)、脾脏切除术(38.6%)、肝脏部分切除术(15.8%)、腹腔淋巴结切除术(7%)、肠道切除术(53.8%)以及造瘘术(32.3%)。超根治性手术难度增大,手术时间延长,严重的围术期并发症会增加。针对晚期卵巢癌患者初始治疗方式的四项临床研究中,手术并发症的比较见表6。
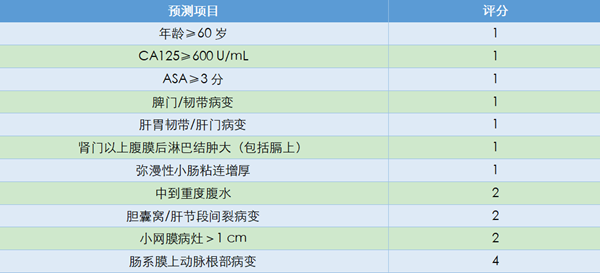
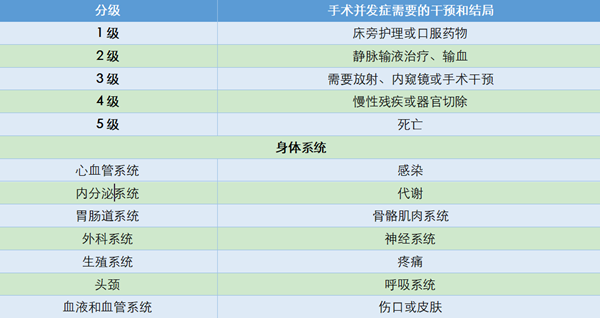
成功的肿瘤细胞减灭术达到肉眼无可见病灶,势必需要更大的手术范围和更长的手术时间。手术治疗的效果和安全性均是评估手术可行性需要考虑的因素。2016年Fagotti团队[18]发表的单中心研究结果,根据患者病史、术前体格检查、化验检查及腹腔镜肿瘤负荷评估情况,预测术后30天并发症发病率的风险,建立了术后并发症预测模型(表7)。
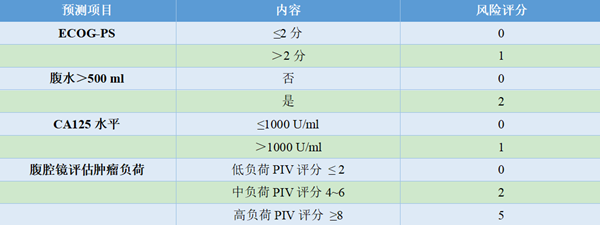
研究发现,低蛋白血症与腹水高度相关,手术难度与肿瘤负荷高度相关,故将预测项目确定为一般情况评分(ECOG评分)、腹水量、CA125结果及腹腔镜肿瘤负荷情况。研究纳入555例患者,分期如下,IIIC期占87.9%、IV期占12.1%,R0切除率达75.1%。术后30天3~4级严重并发症发生率为18.3%,5例患者术后死亡。术后并发症分级依据的是MSKCC并发症分级(表8)。
其中研究定义高危组评分6~8分,中位PFS为13月;中危组评分3~5分,中位PFS为16个月;低危组评分0~2分,中位PFS为36个月。卵巢癌超根治术的应用提高了手术R0切除率,提高了患者的生存获益,同时手术复杂程度增加,手术时间延长,术后严重并发症增加。对于高危评分患者,NACT在一定程度上降低了手术难度,减少了手术并发症,是否能带来生存获益?
基于既往前瞻性研究结果,NACT可能对高肿瘤负荷组患者有生存获益。SCORPION研究[10]采用优效性设计,试图证明NACT对高危评分患者的生存获益,2020年公布了该研究数据。入组晚期卵巢癌患者171例,其中PDS组84例,IDS组87例;IIIC期患者占87.7%,IV期患者占12.3%,两组R0切除率分别为46%和58%(P=0.001)。53例发生术后并发症,在两组分别占比25.9%和7.6%(P=0.0001)。两组PFS分别为15个月、14个月,OS分别为41个月、43个月。
SCORPION患者入组标准如下,IIIC~IV期腹腔镜活检冰冻病理结果提示上皮性卵巢,ECOG评分0~2分,预期寿命至少4周,血液、骨髓、呼吸、肝脏、心脏和肾功能(肌酐清除率>60 ml/min)均在正常范围。排除标准是,过去5年内有妊娠史或哺乳史和/或其他侵袭性恶性肿瘤病史,高肿瘤负荷(PIV 8~12分),但没有肠系膜挛缩的患者。
研究结果发现,PDS组病灶残留位于肝门、腹膜后,NACT-IDS组病灶残留于腹腔;PDS组手术复杂性评分明显高于NACT-IDS组;PDS组平均手术时间460.6分,NACT-IDS组平均手术时间253.2分,PDS组住院时间明显延长(表9)。至于MSKCC术后并发症分级,PDS组3~5级严重并发症发生率明显高于NACT-IDS组,3例围术期(30天内)死亡均发生在PDS组。
研究结果提示,高肿瘤负荷的晚期卵巢癌患者行NACT-IDS治疗,严重并发症较少,生活质量评分好于PDS组。腹腔镜评分系统可以指导术者进行合理的选择。尽管NACT可以带来更高的R0切除率,却没有明确的生存获益。
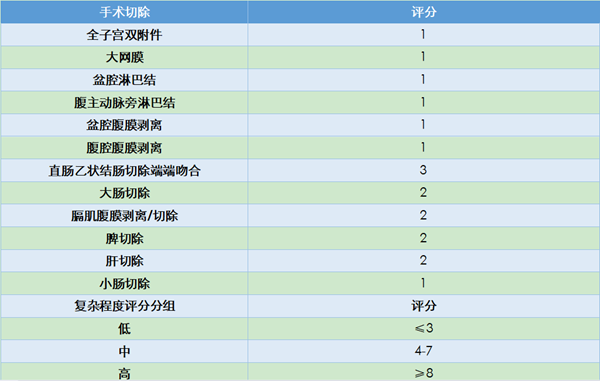
基于目前的研究结果,无残留地切除肿瘤病灶是晚期卵巢癌患者最重要的独立预后因素。骨盆外转移灶小于5 cm的FIGO III期患者,采用PDS治疗有更好的PFS。高危评分的晚期卵巢癌患者采用NACT可以提高手术R0切除率,减少手术严重并发症,但没有明确的生存获益。
综上所述,确定晚期卵巢上皮性癌患者的最佳治疗选择,要充分评估手术R0切除可能性、手术复杂程度和围术期严重并发症风险。根据医疗机构设备及医生的专业技术能力,借助腹腔镜或影像学检查评估肿瘤负荷和肿瘤位置,结合术前检查(年龄、一般情况和营养状态),评价患者承受长时间手术的能力,为患者提供更加精准的治疗选择。
随着医疗技术水平的进步,靶向药物的应用,以及对卵巢癌相关放射学、遗传学、病理学和免疫学等变量影响的不断研究,进一步确定哪些患者可能从NACT后的IDS中获得最大益处。引入各种指标评分对患者分层,引领手术走向精准时代。
参考文献
1. Cao W, ChenHD, Yu YW. Changing profiles of cancer burden worldwide and inChina: a secondary analysis of the global cancer statistics 2020 [J]. ChinesMed J-Peking. 2021, 134(7): 783-791.
2. Cancer Research UK. Cancer stats report - ovariancancer. March, 2011. http://publications.cancerresearchuk.org/downloads/Product/CS_CS_OVARY.pdf (accessedJuly 3, 2014).
3. Bristow RE, Tomacruz RS, Armstrong DK, et al.Survival effect of maximal cytoreductive surgery for advanced ovarian carcinomaduring the platinum era: a meta-analysis [J]. J Clin Oncol. 2002, 20: 1248-1259.
4. du Bois A, Reuss A, Pujade-Lauraine E, et al.Role of surgical outcome as prognostic factor in advanced epithelial ovariancancer: a combined exploratory analysis of 3 prospectively randomized phase 3multicenter trials: by the arbeits gemeinschaft gynaekologische onkologiestudien gruppe ovarial karzinom (AGO-OVAR) and the Groupe d’Investigateurs NationauxPour les Etudes des Cancers de l’Ovaire (GINECO)[J]. Cancer. 2009, 115,1234–1244.
5. Polterauer S, Vergote I, Concin N, et al.Prognostic value of residual tumor size in patients with epithelial ovariancancer FIGO stages IIA-IV: analysis of the OVCAD data [J]. Int J GynecolCancer. 2012, 22, 380-385.
6. van der Burg ME, van Lent M, Buyse M, et al. Theeffect of debulking surgery after induction chemotherapy on the prognosis inadvanced epithelial ovarian cancer. Gynecological Cancer Cooperative Group ofthe European Organization for Research and Treatment of Cancer [J]. N Engl JMed. 1995, 332: 629-634.
7. Vergote I, Tropé CG, Amant F, et al. Neoadjuvantchemotherapy or primary surgery in stage IIIC or IV ovarian cancer [J]. N EnglJ Med. 2010, 363, 943-953.
8. Kehoe S, Hook J, Nankivell M, et al. Primarychemotherapy versus primary surgery for newly diagnosed advanced ovarian cancer(CHORUS): an open-label, randomised, controlled, non-inferiority trial [J].Lancet. 2015, 386: 249-257.
9. Onda T, Satoh T, Saito T, et al. Comparison oftreatment invasiveness between upfront debulking surgery versus intervaldebulking surgery following neoadjuvant chemotherapy for stage III/IV ovarian,tubal, and peritoneal cancers in a phase III randomised trial: Japan ClinicalOncology Group Study JCOG0602 [J]. Eur J Cancer. 2016, 64: 22-31.
10. Fagotti A, Ferrandina MG, Vizzielli G, et al.Randomized trial of primary debulking surgery versus neoadjuvant chemotherapyfor advanced epithelial ovarian cancer (SCORPION-NCT01461850) [J]. Int JGynecol Cancer. 2020, 30(11): 1657-1664.
11. Mahner S, Heitz F, Burges A, et al. TRUST: Trial of radical upfront surgical therapy in advancedovarian cancer (ENGOT ov33/AGO-OVAR OP7)[J]. J Clin Oncol. 2017, 35,TPS5602.
12. Study of upfront surgery versus neoadjuvantchemotherapy in patients with advanced ovarian cancer (SUNNY). https://clinicaltrials.gov/ct2/show/NCT02859038 (accessed on 18 Oct. 2019)
13. Vergote I, Tropé CG, Amant F, et al.Neoadjuvant chemotherapy or primary surgery in stage ⅢC or Ⅳ ovarian cancer[J]. N Engl J Med. 2010,363(10):943-953.
14. Fagotti A, Ferrandina G, Vizzielli G, et al.Phase III randomised clinical trial comparing primary surgery versusneoadjuvant chemotherapy in advanced epithelial ovarian cancer with high tumourload (SCORPION trial): final analysis of peri-operative outcome [J]. Eur JCancer. 2016, 59: 22-33.
15. Fagotti A, Vizzielli G, De Iaco P, et al. Amulticentric trial (Olympiae MITO 13) on the accuracy of laparoscopy to assessperitoneal spread in ovarian cancer [J]. Am J Obstet Gynecol. 2013, 209:462.e1-11.
16. Suidan RS,Ramirez PT,Sarasohn DM, et al. A multicenter assessment of the ability ofcomputed tomography scan and CA125 to predict gross residual disease at primarydebulking for advanced epithelial ovarian cancer [J]. Gynecol Oncol. 2017,145(1): 27-31.
17. Ang C, Chan KKL, Bryant A, et al. Ultra-radical(extensive) surgery versus standard surgery for the primary cytoreduction ofadvanced epithelial ovarian cancer. Cochrane Database of Systematic Reviews2011, Issue 4. Art. No.: CD007697.
18. Vizzielli G, Costantini B, Tortorella L,et al. laparoscopic risk-adjusted model to predict major complications afterprimary debulking surgery in ovarian cancer: A single-institution assessment[J]. Gynecol Oncol. 2016, 142(1): 19-24.
19. Aletti GD, SantillanA, EisenhauerEL, et al. A new frontier for quality of care in gynecologic oncologysurgery: multi institutional assessment of short-term outcomes for ovariancancer using a risk adjusted model [J]. Gynecol Oncol. 2007,107(1): 99-106.

耿宇宁,首都医科大学附属北京妇产医院妇瘤科副主任医师,医学硕士,中国老年医学学会妇科分会委员。
专业特长:从事妇产科临床工作20年,专注于妇科肿瘤的临床诊疗10余年,熟练掌握子宫肌瘤、卵巢良性肿瘤、宫颈癌前病变、子宫内膜癌前病变、宫颈癌、子宫内膜癌、卵巢癌的综合治疗;擅长开腹及腹腔镜下宫颈恶性肿瘤、子宫内膜恶性肿瘤、卵巢恶性肿瘤、外阴肿瘤的手术治疗以及宫颈癌前病变筛查及阴道镜检查,对妇科恶性肿瘤的筛查、诊断、手术和放化疗等综合治疗具有一定的临床经验。

吴玉梅,主任医师、二级教授、博士生导师,首都医科大学附属北京妇产医院妇瘤科主任。
学术兼职:中华医学会妇科肿瘤分会委员、北京医学会妇科肿瘤学分会副主任委员、北京妇产学会外阴阴道疾病分会副主委、北京医学会肿瘤学分会委员、中国老年医学学会妇科分会会长。
擅长领域:致力于妇科肿瘤临床、科研和教学工作。
主要研究方向:宫颈癌放射敏感及放射抵抗机制、妊娠合并宫颈病变的筛查策略、妇科恶性肿瘤的预防。
科研成果:发表妇科肿瘤相关SCI论文30余篇,中文核心期刊论文100余篇;主持国家基金、省科技重点研发项目等多项,获省部级科技奖3项,国家发明专利1项。
个人荣誉:全国医德标兵、北京市先进工作者、北京市三八红旗奖章等。
吴玉梅教授妇科肿瘤知名专家团队简介
首都医科大学附属北京妇产医院妇瘤科是国家重点科室,每年诊治妇科恶性肿瘤患者上千例,拥有北京市唯一的妇科肿瘤临床及组织样本库。是全国少数可进行手术、放疗、化疗、靶向及免疫等综合性治疗的科室。目前拥有多项国际及国家临床试验进行中。
吴玉梅教授从事妇科肿瘤临床工作30余年,致力于妇科肿瘤如宫颈癌、卵巢癌及子宫内膜癌等疑难杂症相关研究,擅长宫颈癌及癌前病变、子宫恶性肿瘤、卵巢良恶性肿瘤以及妊娠期合并妇科肿瘤的诊断及治疗,包括手术、放疗、化疗、内分泌治疗、靶向治疗及免疫治疗等;现兼任中华医学会妇科肿瘤分会委员、北京医学会妇科肿瘤学分会副主任委员、北京妇产学会外阴阴道疾病分会副主委、北京医学会肿瘤学分会委员、中国老年医学学会妇科分会会长等职务,国务院特贴专家;主持国家级、省部级等多项课题;出版专著2部,发表学术论文100余篇发表SCI 文章30余篇,多次获得妇幼健康科技成果奖和华夏医学科学技术奖;获得的个人荣誉包括全国医德标兵、北京市先进工作者、北京市三八红旗奖章等。
吴玉梅教授领衔的妇科肿瘤知名专家团队,成员有主任医师、副主任医师、主治医师、住院医师10余名,以及博士、硕士研究生20余名,致力于各种妇科肿瘤及疑难病例的临床、教学及科研工作。




