子宫颈癌是严重威胁我国女性生命健康的一大杀手,根据世界卫生组织国际癌症研究署的统计,2020年我国子宫颈癌新发病例和死亡病例约为11万和5.9万例,分别占全球新发病例和死亡病例的18%和17%[1-2]。
研究显示,高危型HPV的持续性感染是子宫颈癌发生的主要原因,这一病因学关系的确定带来了宫颈癌筛查策略的重大变革。2014年,基于47000多人超过三年的随访研究数据,美国FDA批准了首个可单独用于宫颈癌初筛的HPV DNA检测试剂,其对宫颈高级别以上病变及原位癌的敏感性达93.5%[3]。这一突破性的进展,推动了全球宫颈癌筛查策略的重大变革——从细胞学检查为基础的诊断性策略转变为基于HPV检测为基础的风险策略。
目前,国内绝大多数城镇妇女健康体检中,宫颈癌筛查仍以细胞学检查为主。为促进新策略的应用,提高筛查的质量和效率,2022年10月郎景和院士和曾强教授携百位宫颈癌防控专家,共同推出了《HPV DNA检测应用于健康体检人群子宫颈癌初筛的专家共识》,发表于《中华健康管理学杂志》。

HPV DNA检测应用于健康体检人群子宫颈癌初筛的专家共识
共识为宫颈癌筛查新策略的推广和应用提供了切实可行的循证建议和规范化指导,推出了5项HPV DNA检测应用于健康体检的共识意见。
共识意见1:推荐高危型HPV DNA检测作为体检人群首选的子宫颈癌初筛方法。
细胞学检查主要依赖细胞病理医生的主观经验判断,准确性偏低、可重复性较差,其对于CIN2+的特异度>90%,灵敏度仅为53%~81%[4],虽然细胞学检查具有较好的特异性,但其较低的灵敏度及阴性预测值,使其预测长期风险的应用价值较低。
国内外大量证据表明,HPV检测筛查CIN2+的灵敏度可达97%,特异度达85%[5-7]。同时,HPV检测主要通过仪器检测判别,具有更好的客观性。已获FDA批准的一线单独初筛HPV检测,不仅效果优于单独细胞学筛查,而且几乎等同于细胞学与HPV联合筛查,体现出更好的灵敏度和更高的阴性预测价值,其结果阴性的人群,三年内罹患宫颈癌的人极少。
因此,相比细胞学筛查方法,HPV检测可以最大限度地筛查出高风险人群,从而早期发现癌前病变,避免子宫颈癌的发生,同时可以延长筛查间隔,提高筛查效率。
共识意见2:高危型HPV特指WHO确认的14种高危HPV亚型;推荐HPV16/18分型检测用于进一步风险人群的分层,检测应为定性检测。
2021年WHO发布的第二版宫颈癌筛查指南《子宫颈癌前病变筛查和治疗指南》和2022年国家卫生健康委员会研究制定的《子宫颈癌筛查工作方案》,推荐、确立了高危型HPV 检测用于子宫颈癌初筛。WHO特别强调:HPV DNA检测特指对一组高致癌性HPV基因型的检测,包括14种高危HPV型别(HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68)。
为什么HPV DNA检测不包括其他亚型(如HPV53型)呢?对此,我们做个特别解析:世界卫生组织-国际癌症研究署的研究显示,HPV53型在低级宫颈病变(LSIL)并不少见(检出率超过10%),但宫颈鳞癌检出率仅为0.2%[8],宫颈腺癌中未见,显示该亚型感染主要引发低级病变(超过60%低级病变可转归正常),极少见宫颈癌的发生。因此,国际癌症研究署将此类HPV亚型归类为缺乏充分证据可致癌亚型。对此类HPV亚型的检测,势必带来致癌风险不明确的检测结果,引发受检者过度焦虑,可能导致临床医生错误处置和过度医疗。
因此,对大多是健康的体检者来说,HPV DNA检测应最大限度地综合考虑筛查的获益、经济负担和危害,避免过度检测。扩大非高危亚型的检测和盲目扩大分型,所获得的阳性结果可能误导临床医生错误的处置和治疗,导致众多健康体检人群不必要的焦虑和经济负担。
共识意见3:推荐HPV DNA检测人群为25岁以上,有性生活的女性,综合国际与国内的HPV初筛流程,本共识确定筛查流程如下图
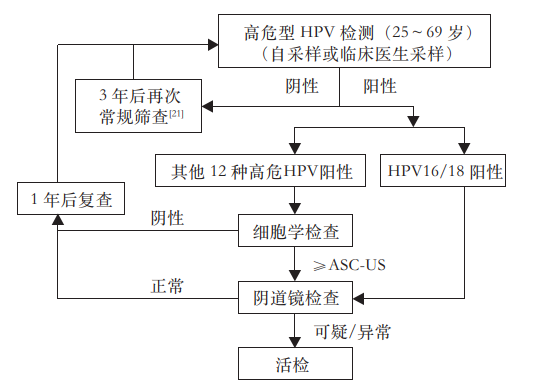
健康体检人群HPV初筛流程图
这一流程图,综合参考了美国ASCCP《高危HPV检测用于子宫颈癌初筛的过渡期指南(2015年)》、WHO《子宫颈癌前病变筛查和治疗指南第二版(2021年)》、国家卫生健康委《子宫颈癌筛查工作方案(2022年)》推荐的HPV筛查流程,对检测人群从65岁扩展到69岁,主要基于超过65岁人群中,既往从未进行过宫颈癌筛查人群较多,同时,罹患宫颈癌并不少见。
共识意见4:进行HPV DNA检测可采用临床医生采集的子宫颈样本或受检者自采样,首选经临床验证的基于PCR技术的DNA检测方法。
过去的十余年,国内外对女性自取样本进行宫颈癌筛查研究已经取得多项成功案例。2010年Wu等在一项横断面的大人群宫颈癌筛查研究SHENCCAST-Ⅱ项目中,首次将一种基于多重PCR的基因分型加质谱平台检测技术MALDI-TOF-MS应用于自取样的检测,获得了与医生取样同样高的CIN3+检测敏感性(94.3% vs 94.3%)[9],由此证实以PCR为基础的HPV检测技术是自取样检测成功的关键;Stanczuk 等在2016年苏格兰完成的1项纳入超过16万例的基于人群的子宫颈癌筛查(PaVDaG)研究中,Cobas-HPV检测阴道自取样本与医生取样本相比,对检出CIN2+/3+的敏感度均可以达到97%[10]。
2021年7月,基于充分的研究证据,WHO首次向全球推荐了女性自采样筛查宫颈癌模式。基于临床验证的PCR技术的高危型HPV检测方法,阴道自采样本和医生采集的宫颈样本筛查出CIN2+/3+的灵敏度和特异度几乎一致[11]!
自采样HPV检测提供了一种新的宫颈癌筛查方式,使卫生医疗机构能够克服社会文化、经济及交通等障碍开展宫颈癌筛查,向妇女提供自采样检测将有助于其接受并更易获得筛查,提高筛查覆盖率。基于经临床验证的PCR技术是自采样HPV DNA检测的首选方法,对CIN2+/3+的灵敏度和特异度几乎等同于医生采样。
因此,共识建议自采样需遵循专业指导,首选经临床验证的基于PCR技术的DNA检测方法。
共识意见5:推荐优选国内外权威机构认可的应用于子宫颈癌初筛的HPV试剂,或经国家药品监督管理局临床一致性考核,检测性能与初筛试剂高度一致的产品。
宫颈癌筛查中,HPV检测的目的是要检出癌前病变和宫颈癌,同时捕获出未来可能罹患宫颈癌的风险人群,而非检测出病毒本身!因此,经临床验证,确定良好的HPV检测性能,是开展HPV检测初筛宫颈癌的基础。
良好的性能主要体现在发现病变和减少对一过性感染的检出两方面的能力。2012年美国三大宫颈癌防控权威机构(ACS、ASCCP和ASCP)联合发布《子宫颈癌预防和早期筛查指南》,指出子宫颈癌初筛应最大化筛查的益处:筛查出可能进展为浸润癌的癌前病变,HPV检测对其灵敏度应≥90%。同时要最小化筛查的潜在危害,即避免对一过性HPV感染及其相应良性病变的探查和不必要的治疗。2014年美国FDA批准首个获得单独初筛的cobas HPV,通过 47000名女性的临床大样本验证,设定临床cut-off 值[12],在不牺牲检测病变的敏感性基础上(>90%),减少了对一过性感染的检出。
中华预防医学会妇女保健分会编写的《子宫颈癌综合防控指南》指出,用于子宫颈癌筛查的HPV检测应以CIN2+作为研究判定终点,检测CIN2+/3+的灵敏度应该至少≥90%。应平衡好检测的灵敏度和特异度,减少漏诊,即假阴性(异常子宫颈报告为正常),以避免失去早期发现和治疗的机会;同时,也要减少误诊,即假阳性(正常子宫颈被认为异常),导致不必要的焦虑、过度的检查或治疗。为此,国家药监局出台的相关指导原则指出,为能够获得理想的临床灵敏度和临床特异度,建议采用ROC曲线确定阳性判断值(cut-off)。
HPV检测试剂对结果影响巨大,产品质量的可靠性尤其重要!需要指出的是,目前我国市场上的HPV检测产品种类繁多,质量良莠不一。因此,初筛使用的HPV DNA检测试剂须经国家药品监督管理局严格的临床验证,证实用于子宫颈癌筛查结果可靠的产品方可使用。


本文仅供医疗卫生专业人士为了解资讯使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解资讯以外的目的,平台及作者不承担相关责任。




